Uchwała Nr ZO 60/14 w sprawie reklamy firmy Abbott Laboratories Poland Sp. z o.o.
Uchwała Nr ZO 60/14
z dnia 8 lipca 2014 roku
Zespołu Orzekającego
w sprawie sygn. Akt:
B/04/14
1. Zespół Orzekający Komisji Etyki Reklamy, działającej przy Związku Stowarzyszeń Rada Reklamy, w składzie:
1) Marcin Senderski – przewodniczący,
2) Krystyna Jarosz – członek,
3) Andrzej Garapich – członek,
na posiedzeniu w dniu 8 lipca 2014 roku, po rozpatrzeniu skargi o sygnaturze akt B/04/14 złożonej, na podstawie pkt. 7 Regulaminu Rozpatrywania Skarg, przez Johnson&Johnson Poland Sp. z o.o. z siedzibą w Warszawie (dalej: Skarżący), przeciwko reklamie w formie ulotki reklamowej leku Tiorfan firmy Abbott Laboratories Poland Sp. z o.o. z siedzibą w Warszawie (dalej: Skarżony)
postanawia
uznać, że w reklamie należy wprowadzić zmiany, aby usunąć naruszenie norm Kodeksu Etyki Reklamy.
2. Zespół Orzekający ustalił, co następuje:
Do Komisji Etyki Reklamy wpłynęła skarga o sygnaturze akt B/04/14.
Przedmiotem skargi była reklama w formie ulotki reklamowej kierowanej do lekarzy i farmaceutów, leku dostępnego w aptekach bez recepty o nazwie Tiorfan.
Skarżący uczestniczył w posiedzeniu.
Skarżący w prawidłowo złożonej skardze podniósł:
„W ocenie Johnson&Johnson Poland sp. z o.o. (dalej „J&J”) Hasło:
„SZYBKOŚĆ. Maksymalny efekt działania szybszy od loperamidu”, to przykład przekazu reklamowego, który jest sprzeczny z prawem i dobrymi obyczajami.
W szczególności Hasło jest przykładem reklamy wprowadzającej w błąd i stanowi niedozwoloną reklamę porównawczą, co stoi w sprzeczności z przepisami o reklamie zawartymi w ustawie z dnia 6 września 2001 roku Prawo farmaceutyczne (art. 53 ust. 1 i 54 ust. 2 ustawy prawo farmaceutyczne Dz. U. z 2001, Nr 126, poz. 1381 z późn. zm.) oraz w ustawie z dnia 16 kwietnia 1993 roku o zwalczaniu nieuczciwej konkurencji (t.j. Dz.U. z 2003r.; Nr 153, poz. 1503 z późn. zm.) i narusza postanowienia art. 8 oraz art. 10 ust. 1 lit. a, art. 10 ust. 2 oraz art. 11 ust. 1 i 2 Kodeksu Etyki Reklamy.
J&J jest przedstawicielem podmiotu odpowiedzialnego i zarazem dystrybutorem produktu leczniczego na biegunkę pod nazwą Imodium. Imodium zawiera substancję czynną chlorowodorek loperamidu.
Abbott posiada w swojej ofercie także lek, którego zadaniem jest zwalczanie objawów biegunki. Jest to lek pod nazwą Tiorfan, który w odróżnieniu od Imodium zawiera inną substancję czynną tj. racekadotryl.
I. Hasła jako przykład reklamy wprowadzającej w błąd
Postulat, aby przekaz reklamowy nie wprowadzał w błąd jest jednym z fundamentalnych postulatów prawa i elementem dobrych obyczajów. Nawet prawdziwe informacje mogą być formułowane w sposób nierzetelny, nieścisły lub tendencyjny. Każda reklama, ale zwłaszcza reklama leków, powinna więc operować takimi przekazami, które są sformułowane w sposób precyzyjny, rzetelny i obiektywny.
Ustawa o zwalczaniu nieuczciwej konkurencji zakazuje prowadzenia reklamy wprowadzającej w błąd i mogącej przez to wpłynąć na decyzje zakupowe klientów (art. 16 ust.l pkt 2 ustawy).
Prawo farmaceutyczne stanowi, że reklama nie może wprowadzać w błąd i powinna prezentować produkt leczniczy obiektywnie (art. 55 ust. 1 ustawy). Co więcej, zgodnie z art. 54 ust. 2 prawa farmaceutycznego zabroniona jest reklama skierowana do profesjonalistów, która zawiera nierzetelne, nieaktualne, niesprawdzalne i niekompletne informacje, uniemożliwiając tym samym dokonanie przez odbiorców reklamy własnej oceny o właściwościach terapeutycznych produktu leczniczego.
Podobne zasady odnajdziemy w Kodeksie Etyki Reklamy, który m.in. stanowi, że reklama nie może wprowadzać w błąd jej odbiorców, w szczególności w odniesieniu do istotnych cech, w tym właściwości, składu, metody, daty produkcji, przydatności, ilości, pochodzenia (w tym geograficznego) reklamowanego produktu, zaś użyte w reklamie dane oraz nieobjęte tym pojęciem w rozumieniu Kodeksu terminy naukowe, cytaty z publikacji technicznych lub naukowych muszą wskazywać źródło oraz nie mogą być używane w sposób wprowadzający w błąd. Dane muszą być prezentowane w sposób poprawny metodologicznie.
Hasło „SZYBKOŚĆ. Maksymalny efekt działania szybszy od loperamidu”, jak czytamy w ulotce poparte jest wg Abbott następującymi okolicznościami:
(i) Maksymalna inhibicja enkefalinazy w osoczu osiągana jest po o. dwóch godzinach i odpowiada za hamowanie 75% po dawce 100 mg oraz
(ii) Loperamid – maksymalny efekt działania po 16-24 godzinach od przyjęcia na podstawie:
– Charakterystyki Produktu Leczniczego Tiorfan zatw. dnia 26.12.2012 (przyp. wł. Dane farmakodynamiczne produktu);
– Regnard C et al, J Pain Symptom Manage, 2011, 42(2), 319-323 (“Publikacja”).
Zarówno Hasło, jak i wskazane przez Abbott uzasadnienie naruszają przepisy prawa powszechnie obowiązującego oraz przepisy Kodeksu Etyki Reklamy.
a) Nierzetelność badań
Już na wstępie należy zaznaczyć, iż Abbott na poparcie Hasła odnosi się do Publikacji, która jest źródłem pośrednim. Publikacja w swojej treści odsyła bowiem do badań z 1995 roku Dreveman JWM et al. Loperamide oxide in acute diarrhoea: a double blind placebo-controlled trial (“Badania”). Badania, na które Abbott wskazuje w sposób pośredni, były przeprowadzone jedynie w odniesieniu do jednej substancji (nie były badaniami porównawczymi) tj. tlenku loperamidu.
Reklama skierowana jest do polskich profesjonalistów, więc powinna odnosić się do preparatów dostępnych na polskim rynku. Tlenek loperamidu taką substancją nie jest. Popularne leki przeciwbiegunkowe obecne na polskim rynku (Stoperan, Laremid, Loperamid, Imodium, Lopacut) zawierają chlorowodorek, a nie tlenek loperamidu. Hasło odnosi się do loperamidu, co jednoznacznie sugeruje, iż Badania mogą dotyczyć także chlorowodorku loperamidu (substancji powszechnej w Polsce), podczas gdy w rzeczywistości dotyczy innej pochodnej substancji. Co więcej, jak wynika z Badań tlenek loperamidu odbiega w swojej efektywności od innych postaci loperamidu („serum level of loperamide achieved after ingestion of loperamide oxide is only half of that produced by loperamide itself” patrz Badanie strona 445).
Odnosząc się zaś do Publikacji, czyli źródła podanego na ulotce, to pomijając aspekt, iż jest to źródło pośrednie, to należy przede wszystkim podkreślić, iż Publikacja nie zawiera żadnych konkretnych danych medycznych, a jedynie stwierdzenie, iż maksymalny efekt terapeutyczny loperamidu może się nie ujawnić w ciągu 16 – 24 h (cit. its maximum therapeutic impact may not manifest for 16-24 h). Takie stwierdzenie nie jest stwierdzeniem konkretnych faktów naukowych, a jedynie spekulacją. Co więcej, próżno szukać takiego stwierdzenia w Badaniach, do których Publikacja odsyła.
Na uwagę zasługuje także fakt, iż Abbott na poparcie Hasła o charakterze porównawczym nie odwołuje się do badań klinicznych porównujących dwie substancje, ale do dwóch osobnych i w dodatku nie kompatybilnych właściwości obu produktów. Należy wskazać, iż w literaturze naukowej dostępne są badania, bezpośrednio porównujące właściwości obydwu substancji. W 1999 roku zostały opublikowane wyniki badań klinicznych pn. Comparison of racecadotrU and loperamide in adults with acute diarrhoea (publ. Blackwell Science Ltd., Aliment Pharmacol Ther 13 (suppl. 6), 21-26), które to badania w konkluzji jednoznacznie wskazują, iż racekadotryl oraz loperamid są porównywalnie skuteczne, zarówno w odniesieniu do ilości oddawanych przez pacjentów stolców, długości trwania biegunki, jak i ogólnej oceny lekarzy (cit.: „In conclusion, the results of this study confirm that racecadotril was similar in efficacy to loperamide in terms of the number of stools passed until recovery, duration of diarrhea, and physician’s global evaluation’). Także wskazane w tejże publikacji wykresy wskazują, iż czas reakcji obydwu substancji był porównywalny. Tym samym dostępne badania porównawcze nie pozwalają na stwierdzenie, że dana substancja działa szybciej.
Podsumowując, zarówno Publikacja, jak i Badania, do których Publikacja się odwołuje, odnoszą się do substancji czynnej nieobecnej na polskim rynku, zaś uzasadnienie Hasła poparte jest spekulacją, a nie rzetelnym badaniem porównawczym, podczas gdy z dostępnych badań naukowych o charakterze porównawczym nie wynika, jakoby racekadotryl był substancją która działa szybciej niż loperamid, zaś maksymalny efekt działania obydwu substancji jest zbliżony w czasie.
b) Porównanie dwóch rozbieżnych wskaźników
Nawet, jeżeli przyjąć, iż Badanie, a w konsekwencji Publikacja, odnosi się do chlorowodorku loperamidu (substancji obecnej na polskim rynku), to i tak w ocenie Skarżącego przyjęte przez Abbott uzasadnienie wprowadza w błąd i jest nierzetelne.
J8J stoi na stanowisku, iż Abbott porównuje dwie zupełnie nieporównywalne właściwości. Dane farmakodynamiczne (czyli mechanizm działania racekadotrylu) zestawia z danymi klinicznymi loperamidu (kliniczny efekt biegunki – rozumiany jako ustąpienie objawów).
Nie jest prawdą, iż maksymalny efekt terapeutyczny (maksymalny efekt działania po 16-24 godzinach od przyjęcia), jak twierdzi Abbott odnosi się do właściwości farmakodynamicznych loperamidu. Wręcz przeciwnie, brak jest jakiekolwiek uzasadnienia, że spekulacja zawarta w Publikacji dotyczy takich danych. Nawet jeżeli hipotetycznie przyjąć założenie, iż stwierdzenie maksymalny efekt dotyczy danych farmakodynamicznych, to Hasło nadal będzie wprowadzało w błąd, albowiem Badanie w istocie odwołuje się do efektu klinicznego loperamidu, a nie farmakodynamicznego. Takie wnioski nasuwają się po wnikliwej lekturze Badania i takich stwierdzeniach, jak: time to first relief, the median time to first relief of diarrhoea, the median time to complete relief. Ubocznie należy tylko wskazać, iż próżno szukać w Badaniach stwierdzenia potwierdzającego cytat w Publikacji, iż maksymalny efekt działania loperamidu po 16-24 godzinach od przyjęcia.
Nie sposób zgodzić się także ze stwierdzeniem, iż profesjonaliści po lekturze ulotki będą mogli rozpoznać z łatwością, czego dotyczy pojęcie maksymalny efekt. Większość profesjonalistów utożsamia termin maksymalny efekt z efektem klinicznym, chyba że z treści wyraźnie wynika, że dany efekt nie ma nic wspólnego ze skutecznością kliniczną. Dlatego też w ocenie Skarżącego Abbot porównuje dwie niezależne od siebie właściwości. Porównanie, aby sprostać wymaganiom porównania rzetelnego i niewprowadzającego w błąd musi się odnosić do tych samych parametrów obu produktów, albowiem właściwości farmakodynamiczne produktu nie mają przełożenia na skuteczność kliniczną danego preparatu.
Ponadto, nawet jeżeli przyjąć, iż profesjonaliści odczytają termin maksymalny efekt, jako wskaźnik farmakodynamiczny, jak twierdzi Abbott, to Hasło nadal będzie wprowadzało w błąd, albowiem Badanie odwołuje się do efektu klinicznego (patrz Badanie). Podsumowując, na poparcie Hasła Abbott podaje dwie zupełnie niezależne od siebie właściwości porównując efekt farmakodynamiczny Tiorfanu (mechanizm działania leku) z efektem klinicznym (ustanie objawów) Ioperamidu. Takie porównanie nie jest porównaniem rzetelnym obiektywnym i nie wprowadzającym w błąd.
Faktem jest, iż obydwa produkty mają różne działalnie farmakodynamiczne i farmakokinetyczne, a więc dokładne porównanie odpowiednich właściwości nie jest z natury rzeczy możliwe.
Tiorfan jest inhibitorem enkefalinazy jelitowej, enzymu białkowego błony komórkowej zlokalizowanego w różnych tkankach, a szczególnie w nabłonku jelita cienkiego. Racekadotryl jest substancją czynną o działaniu przeciwwydzielniczym wyłącznie w obrębie jelit. Zmniejsza nadmierne wydzielanie wody i elektrolitów przez jelita wywołane toksynami cholery lub stanem zapalnym i nie wpływa na podstawową czynność wydzielniczą. Racekadotryl wywołuje szybkie działanie przeciwbiegunkowe bez zmiany ciągłości pasażu przez jelita.
Loperamid wiąże się z receptorami opioidowymi w ścianie jelita. W następstwie tego hamuje uwalnianie acetylocholiny i prostaglandyn, zmniejszając tym samym perystaltykę i wydłużając czas pasażu treści pokarmowej w jelitach. Loperamid zwiększa spoczynkowe napięcie zwieracza odbytu, jednocześnie zmniejszając natychmiastową potrzebę wypróżnienia (parcie na stolec). Ze względu na duże powinowactwo do ściany jelita i duży stopień metabolizmu związany z efektem pierwszego przejścia przez wątrobę loperamid prawie w ogóle nie przenika do krążenia ogólnego.
W ocenie Skarżącego, chcąc porównać szybkość działania obydwu produktów należałoby przyjąć początkowy moment działania produktów (onset of action), który w przypadku loperamidu wynosi 1 h, zaś w przypadku racekadotrylu około 2 h. Takie rzetelne porównanie parametrów nie daje natomiast prawa do wysnucia wniosku, jakoby racekadotryl działał szybciej niż loperamid.
Podsumowując, Hasło narusza przepisy prawa oraz Kodeksu Etyki Reklamy (art. 8 oraz art. 10 ust. 1 lit. a, art. 10 ust. 2 oraz art. 11 ust. 1 i 2) wprowadza w błąd odbiorców i stanowi przykład niedozwolonej reklamy porównawczej albowiem Abbott:
• pośrednio odwołuje się do Badań dotyczących innej substancji czynnej nieobecnej na polskim rynku;
• odwołuje się w Publikacji do stwierdzenia, którego nie istnieje w Badaniach;
• odwołuje się do Publikacji, która jest pośrednim źródłem i która w swej treści zawiera jedynie spekulację, nie zaś do oryginalnych badań;
• na poparcie Hasła o charakterze porównawczym przedstawiono dwa osobne źródła, podczas gdy istnieją badania naukowe porównujące szybkość i skuteczność obydwu substancji;
• Istniejące badania porównawcze wskazują, iż oba produkty są porównywalnie skuteczne klinicznie, zaś działalnie loperamidu rozpoczyna się już po 1 h od przyjęcia tabletki (onest of action);
• powołanie się na właściwości farmakodynamiczne racekadotrylu nie ma przełożenia na szybkość działania produktu, albowiem to co dzieje się we krwi po przyjęciu preparatu (inhibicja enkefalinazy w osoczu) nie ma bezpośredniego przełożenia na to co dzieje się w jelitach;
• porównuje dwa rozbieżne i nieporównywalne ze sobą wskaźniki: właściwości farmakodynamiczne jednego produktu (czas i mechanizm działania) zestawiając je z czasem w, którym loperamid osiąga maksymalną efekt kliniczny.
WNIOSKI:
W oparciu o powyższe wnoszę o podjęcie uchwały zakazującej w jakikolwiek sposób rozpowszechnianie Hasła: „SZYBKOŚĆ. Maksymalny efekt działania szybszy od loperamidu lub innych równoważnych w sposób zapewniający, iż produkt leczniczy Tiorfan działa szybciej niż produkty lecznicze zawierające loperamid.”. – pisownia oryginalna
Załączniki:
– Ulotka leku Tiorfan
– Wezwanie z dnia 17 stycznia 2014 roku wraz z załącznikami
– Odpowiedź Abbott Laboratories Poland sp. z o.o. z dnia 27 lutego 2014 roku
– Regnard C et al, J Pain Symptom Manage, 2011, 42(2), 319-323 (“Publikacja”) wraz z tłumaczeniem na j. polski
– Dreveman JWM et al. Loperamide oxide in acute diarrhoea: a double blind placebo-controlled trial (“Badania”) wraz z tłumaczeniem na j. polski
– J.M. Vetel, H. Berard, N. Fretault, J.M Lecomte: Comparison of racecadotril and loperamide in adults with acute diarrhea wraz z tłumaczeniem na j. polski
Skarżony złożył pisemną odpowiedź na skargę i uczestniczył w posiedzeniu.
W odpowiedzi na pismo z dnia 04.06.2014 pragniemy oświadczyć jak niżej:
a) w opinii Abbott Laboratories Poland Sp. z o.o. ulotka promocyjna Tiorfan o sygnaturze 2013-09- TIO-3024, kierowana do osób uprawnionych do wystawiania recept na produkty lecznicze (dalej „Ulotka”) nie łamie przepisów prawa jak również norm etycznych przyjętych w obrocie lekami.
b) Stwierdzenie J&J: Publikacja Regnard C et al. J Pain Symptom Manage, 2011: 42(2): 319-323 jest źródłem pośrednim.
Dane dotyczące farmakokinetyki i farmakodynamiki loperamidu pochodzą z aktualnego artykułu (opublikowanego w 2011 roku), przygotowanego przez specjalistów z wiodących ośrodków (m.in. Oxford University), z krajów, w których tzw. Evidence Based Medicine jest reprezentowana na najwyższym poziomie (Wielka Brytania, USA). Artykuł zawiera niezależne (niesponsorowane) informacje merytoryczne skierowane do lekarzy i farmaceutów, (źródło: Regnard C et al., J Pain Symptom Manage, 2011; 42(2): 319-323, dalej „Artykuł”).
Artykuł jest przeglądem wiedzy na temat loperamidu ze wszystkich dostępnych źródeł. Źródła te dotyczą zarówno tlenku loperamidu jak i chlorowodorku loperamidu. Abbott nie ma powodu, aby podważać prawdziwość zawartych tam informacji, zwłaszcza, że są one zgodne z informacjami na temat loperamidu pochodzącymi z zatwierdzonych Charakterystyk Produktu Leczniczego (dalej „ChPL”) np. początek działania przeciwbiegunkowego po podaniu pojedynczej dawki 4mg – w ciągu 1 godziny od podania (ChPL Loperamid WZF zatw. 10.07.2012), okres półtrwania loperamidu u człowieka wynosi 9-14 godzin, średnio 10,8 godziny (ChPL Loperamid WZF zatw. 10.07.2012). W Artykule odpowiednie parametry loperamidu wynoszą: początek działania – ok. 1 godziny, okres półtrwania w surowicy – 11 godzin. Wyżej wymienione dane świadczą o wysokiej wiarygodności informacji dotyczących farmakokinetyki i farmakodynamiki loperamidu przedstawionych w Artykule w porównaniu do zatwierdzonych informacji w ChPL. Inne informacje zawarte w Artykule, dotyczące farmakokinetyki i farmakodynamiki loperamidu np. maksymalny efekt działania są trudne do zweryfikowania w oficjalnych drukach informacyjnych zatwierdzonych przez odpowiednie urzędy ponieważ producenci leków zawierających substancję czynną loperamid nie umieścili ich w ChPL. Ponieważ w ChPL loperamidu brakuje wielu istotnych informacji na temat farmakokinetyki/farmakodynamiki loperamidu, dlatego byliśmy zmuszeni posłużyć się niezależnymi publikacjami – np. wyżej wspomnianym Artykułem. Należy przy tym stwierdzić, ze Artykuł zawiera bardziej kompletne informacje na temat farmakokinetyki i farmakodynamiki loperamidu niż ChPL-e przygotowane przez producentów leków.
Jednocześnie pragniemy podkreślić, że ChPL jest również źródłem pośrednim przedstawiającym wyniki różnych badań.
c) Stwierdzenie J&J: „Hasło odnosi się do loperamidu, co jednoznacznie sugeruje, że może dotyczyć także chlorowodorku loperamidu”.
Naszym zdaniem jest to nadinterpretacja tego hasła przez firmę J&J. Nigdzie w Ulotce nie znajduje się stwierdzenie, że hasło dotyczy chlorowodorku loperamidu, więc taka sugestia jest stronniczą interpretacją, niezgodną z zamiarami autorów Ulotki. Artykuł odnosi się ogólnie do loperamidu, a nie do konkretnego związku chemicznego to jest tlenku lub chlorowodorku loperamidu, podobnie jak hasło – w związku z tym wyciąganie wniosków dotyczących konkretnych produktów leczniczych np. Imodium jest nieuprawnioną nadinterpretacją firmy J&J.
d) Stwierdzenie J&J: „Odnosząc się zaś do publikacji, czyli źródła podanego w ulotce, to należy przede wszystkim podkreślić, że publikacja nie zawiera żadnych konkretnych danych medycznych, a jedynie, iż maksymalny efekt terapeutyczny może się ujawnić w ciągu 16-24 h. Takie stwierdzenie nie jest stwierdzeniem konkretnych faktów naukowych, a jedynie spekulacją”.
Publikacja jest właściwie wypełniona konkretnymi danymi medycznymi i wnioskami z licznych badań z różnymi związkami loperamidu, na które się powołuje. Stwierdzenie, że nie zawiera żadnych danych medycznych jest całkowicie nieprawdziwe i naruszające dobra osobiste autorów Artykułu.
e) Stwierdzenie J&J: „Takie stwierdzenie nie jest stwierdzeniem konkretnych faktów naukowych, a jedynie spekulacją”.
Autorzy „Ulotki” nie mieli podstaw, aby kwestionować zawarte w Artykule informacje naukowe, ponieważ część z nich była weryfikowalna i zgodna z informacjami zawartymi w Charakterystykach Produktów Leczniczych zawierających loperamid, a autorzy pochodzą z wiodących ośrodków naukowych na świecie.
f) Stwierdzenie J&J: „Co więcej jak wynika z Badań tlenek loperamidu odbiega w swojej efektywności od innych postaci loperamidu („serum level of loperamide achieved after ingestion of loperamide oxide is only half of that produced by loperamide itself”).
Jest to dobry przykład pokrętnej i wprowadzającej w błąd argumentacji używanej przez firmę J&J w swojej skardze ponieważ:
1) cytat angielski odnosi się do stężenia tlenku loperamidu w surowicy krwi.
2) Wniosek w języku polskim odnosi się do skuteczności klinicznej, która jest zupełnie innym pojęciem niż stężenie tlenku loperamidu w surowicy, ponadto parametry te nie są powiązane związkiem przyczynowo-skutkowym.
3) W tej samej publikacji znajduje się następująca informacja: „Recent studies indicate that loperamide oxide has a similar atidiarrhoeal efficacy as loperamide 25’26) str. 442 Źródło bezpośrednie: Hughes IW. Br J Clin Pract. 1995 Jul-Aug;49(4):181-5. First-line treatment in acute non- dysenteric diarrhoea: clinical comparison of loperamide oxide, loperamide and placebo. UK Janssen Research Group of General Practitioners.
Wniosek z ww. publikacji: skuteczność kliniczna w bezpośrednim badaniu klinicznym tlenku loperamidu i chlorowodorku loperamidu była taka sama, natomiast tlenek loperamidu okazał się powodować mniej działań niepożądanych w porównaniu z chłorowodorkiem loperamidu (prawdopodobnie było to związane z niższym stężeniem tlenku loperamidu w surowicy w porównaniu do chlorowodorku loperamidu).
Zatem dane dotyczące maksymalnego efektu terapeutycznego loperamidu po 16-24 h opublikowane zostały rzetelnie i zgodnie z prawdą przez autorów Artykułu, ponieważ maksymalny efekt terapeutyczny występuje po takim samym czasie niezależnie czy jest stosowany tlenek czy chlorowodorek loperamidu.
g) Stwierdzenie J&J: „…Abbott na poparcie hasła o charakterze porównawczym nie odwołuje się do badań klinicznych porównujących dwie substancje, ale do dwóch osobnych nie kompatybilnych właściwości produktu.”
W stwierdzeniu „Maksymalny efekt działania szybszy od loperamidu” jednoznacznie zostało określone, iż dotyczy ono jednego z parametrów farmakodynamicznych tj. maksymalnego efektu działania, a nie np. skuteczności klinicznej produktu leczniczego (np. stwierdzenie NIE brzmi: Tiorfan skuteczniejszy od loperamidu). Zatem stwierdzenie „…do dwóch osobnych właściwości produktów…” jest nieprawdziwe, ponieważ przedstawione w ulotce dane dotyczą tych samych parametrów farmakodynamicznych to jest maksymalnego efektu działania, a nie porównują skuteczności klinicznej i maksymalnego efektu działania co sugeruje firma J&J.
h) Stwierdzenie J&J: „…z dostępnych badań naukowych o charakterze porównawczym nie wynika jakoby racekadotryl był substancją, która działa szybciej niż loperamid, zaś maksymalny efekt działania obydwu substancji jest zbliżony w czasie”.
Na jakiej podstawie firma J&J opiera takie stwierdzenie? (podkreślenie wyżej), Nie ma żadnych znanych nam doniesień naukowych, które by to stwierdzenie uzasadniały – prosimy o podanie źródła. Firma Abbott w swoim piśmie do firmy J&J z dnia 27.02.2014 poprosiła o udostępnienie publikacji dotyczącej czasu do osiągnięcia maksymalnego efektu działania loperamidu. Do chwili obecnej takiej publikacji firma Abbott nie otrzymała. Maksymalny efekt działania jest pojęciem zupełnie innym niż skuteczność kliniczna.
i) Stwierdzenie J&J: „J&J stoi na stanowisku, że Abbott porównuje dwie zupełnie nieporównywalne właściwości. Dane farmakodynamiczne (czyli mechanizm działania racekadotrylu) zestawia z danymi klinicznymi loperamidu (kliniczny efekt biegunki – rozumiany jako ustąpienie objawów)”.
Jest to stwierdzenie całkowicie nieprawdziwe. Hasło zastosowane przez firmę Abbott jednoznacznie odnosi się do właściwości farmakodynamicznych, a nie klinicznych. Miejsce i kontekst zamieszczenia w Artykule świadczą jednoznacznie o farmakodynamicznym charakterze sformułowania: „Onset of action: about 1h, maximum effect 16-24 h”.
j) Stwierdzenie J&J: „Większość profesjonalistów utożsamia termin maksymalny efekt z efektem klinicznym, chyba że z treści wynika, ze dany efekt nie ma nic wspólnego ze skutecznością kliniczną”.
Firma J&J w naszej opinii bezpodstawnie zakłada iż profesjonaliści jakimi są lekarze i farmaceuci nie rozróżniają omawianych właściwości produktów leczniczych gdyż obowiązek rozróżnienia tak odmiennych współczynników jak „maksymalny efekt” oraz „efekt kliniczny” należy do podstaw ich profesjonalnego wykształcenia. Co więcej sam ustawodawca zarówno polski jak i europejski uznaje iż lekarze i farmaceuci, zważywszy na swoją wiedzę medyczną różnią się od „normalnych” adresatów przekazów reklamowych i można od nich wymagać rozróżnienia podstawowych terminów z zakresu właściwości produktów leczniczych
k) Stwierdzenie J&J: „Faktem jest, ze obydwa produkty mają różne działanie farmakokinetyczne i farmakodynamiczne, a wiec dokładne porównanie odpowiednich właściwości nie jest z natury możliwe”.
Jest to nieprawda, istnieje wiele publikacji porównujących właściwości farmakokinetyczne i farmakodynamiczne różnych leków. Przykład
TABELA 1. Wybrane parametry farmakologiczne makrolidów.
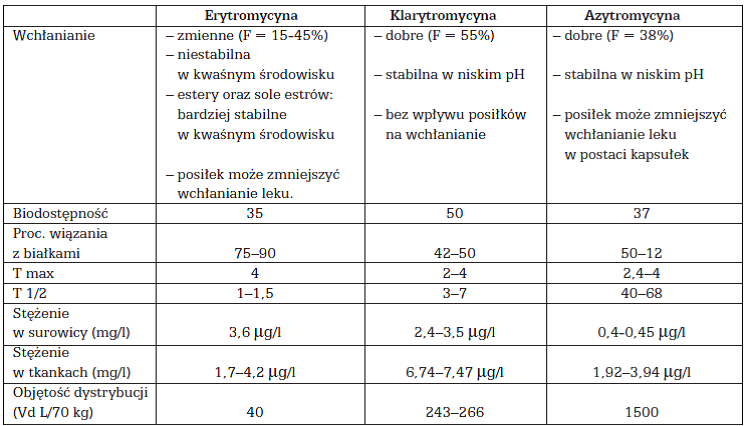
Źródło: Postuła M, Magazyn Otolaryngologiczny 02.2009: wydanie specjalne
http://magazynorl.pl/2009-sierpien-wydanie-specialne/
l) Stwierdzenie J&J: „W ocenie skarżącego chcąc porównać szybkość działania obydwu produktów, należałoby przyjąć początkowy moment działania produktów, który w przypadku loperamidu wynosi 1 h, zaś w przypadku racecadotrylu około 2 h”.
W tym stwierdzeniu firma J&J:
a) sama zaprzecza swoim wcześniejszym stwierdzeniom (patrz Stwierdzenie J&J – podpunkt k)), w których twierdzi, ze nie można porównywać właściwości farmakokinetycznych i farmakodynamicznych loperamidu i racekadotrylu.
b) porównuje dwa różne parametry farmakodynamiczne tzn. początek działania (loperamid) po 1 h, z maksymalnym efektem działania (racekadotryl) po 2 godzinach.
c) Początek działania racekadotrylu występuje po 0,5 h od podania dawki jednorazowej 100mg. Źródło: Lecomte JM Int J Antimicrob Agents. 2000; 14(1): 81-7.
d) Poniżej rzetelne porównanie właściwości farmakokinetycznych i farmakodynamicznych loperamidu i racekadotrylu.
a)Regnard C et al., J Pain Symptom Manage, 2011; 42 (2): 319 – 323.
*ChPL Tiorfan z 12.2012
**Lecomte JM Int J Antimicrob Agents. 2000; 14(1): 81-7. Dawka jednorazowa 100mg
***Xu,Y., J. Chromatogr.B Analyt.Technol.Biomed.LifeSci. 2007; 852, 101-107. Dawka jednorazowa 200mg
b)ChPL Imodium z dnia 10.07.2012
ChPL Loperamide Galpharm z dnia 28.08.2012
ChPL Loperamid WZF z dnia 10.07.2012
Jak widać z powyższego zestawienia, profil farmakokinetyczny i farmakodynamiczny racekadotrylu i loperamidu całkowicie się od siebie różnią, a nie są podobne jak twierdzi J&J.
Dane przedstawione w „Artykule” mają swoje pokrycie w informacjach znajdujących się w zatwierdzonych dokumentach (ChPL) co potwierdza ich wiarygodności rzetelność.
m) W naszej ocenie hasło nie stanowi reklamy porównawczej, ponieważ nie odnosi się do konkretnego produktu leczniczego ani nawet do nazwy konkretnej substancji czynnej (np. chlorowodorku loperamidu). Jakiekolwiek sugestie łączące loperamid z konkretnym produktem leczniczym, a w szczególności produktem leczniczym firmy J&J są jednostronną interpretacją firmy J&J i nie były zamierzeniem autorów projektu Ulotki.
Reasumując – wyżej wymienione stwierdzenia J&J są nieprawdziwe, nie znajdują odzwierciedlenia w literaturze naukowej i są nadinterpretacją firmy J&J.
Pragniemy również poinformować iż w związku ze zmianą strategii marketingowej ulotka produktu leczniczego Tiorfan o sygnaturze 2013-09-Tl0-3024 nie jest używana od stycznia 2014 r.(była stosowana w promocji w czwartym kwartale 2013 roku).
Kończąc pragniemy poinformować Radę Reklamy, że firma Abbott w korespondencji z firmą J&J sygnalizowała gotowość dyskusji w celu wyjaśnienia wszelkich wątpliwości, niestety z przykrością stwierdzamy, że nasza inicjatywa nie spotkała się z jakimkolwiek pozytywnym odzewem ze strony J&J.”. – pisownia oryginalna
3. Zespół Orzekający zważył co następuje:
Zespół Orzekający dopatrzył się w przedmiotowej reklamie naruszenia norm Kodeksu Etyki Reklamy zarzucanych przez Skarżącego, tj. art. 8, art. 10 ust. 1 a), art. 10 ust. 2.
Zespół Orzekający oddalił natomiast zarzut naruszenia art. 11 ust. 1 i 2.
Biorąc pod uwagę, że reklama zawiera hasła:
„SZYBKOŚĆ
Maksymalny efekt działania
szybszy od loperamidu”
Zespół Orzekający wyraził opinię, iż poprzez użycie ww. haseł, reklama może wprowadzać odbiorców w błąd co do właściwości reklamowanego produktu i nadużywać ich zaufania oraz wykorzystywać ich brak doświadczenia lub wiedzy, i to pomimo faktu, że była ona skierowana do wykwalifikowanego odbiorcy. W ocenie Zespołu Orzekającego, tak jednoznaczne stwierdzenia powinny być prezentowane w reklamie w sposób niebudzący wątpliwości, przejrzysty, zrozumiały i niewprowadzający odbiorców w błąd, ponieważ dotyczą one tak wrażliwej sfery jak zdrowie.
Zespół Orzekający wskazał, że hasła zostały użyte w formie skrótu myślowego bez doprecyzowania, że określenie „szybkość” nie odwołuje się do skuteczności klinicznej produktu leczniczego, lecz do jego właściwości farmakodynamicznych – nieistotnych z punktu widzenia terapeutycznego, dlatego w tym zakresie reklama powinna zostać zmodyfikowana.
Zespół Orzekający oddalił natomiast zarzut Skarżącego, dotyczący niedozwolonej reklamy porównawczej uznając, że przedmiotowa reklama nie zawiera cech niedozwolonej reklamy porównawczej w rozumieniu Kodeksu Etyki Reklamy, a informacja zawarta w reklamie nie deprecjonuje konkurencyjnych produktów.
W związku z powyższym, na podstawie pkt 37 ust. 1) lit d) Regulaminu Rozpatrywania Skarg Zespół Orzekający orzekł jak w pkt 1 uchwały.
Zgodnie z pkt.50 Regulaminu Rozpatrywania Skarg z dnia 30 października 2013r., stronom przysługuje prawo do odwołania się od uchwały Zespołu Orzekającego w terminie 10 dni od daty doręczenia uchwały. Podstawę odwołania mogą stanowić wyłącznie nowe fakty i dowody, nieznane zainteresowanej stronie w dacie podjęcia przez Zespół Orzekający uchwały.